SPIRIVA RESPIMAT
TIOTROPIO
Solución para inhalación
Cartucho(s) , Solución para inhalación , 30 Dosis
1 Caja, 1 Inhalador, 30 Dosis, 2,5 µg/dosis
COMPOSICIÓN:
La dosis suministrada es de 2,5 μg de tiotropio por aplicación (2 aplicaciones por dosis). 2,5 μg de tiotropio equivale a 3,124 μg de bromuro de tiotropio monohidrato.
Excipientes: Cloruro de benzalconio, edetato disódico, agua purificada, ácido clorhídrico para ajuste del pH.
INDICACIONES TERAPÉUTICAS:
Indicaciones
EPOC
SPIRIVA RESPIMAT está indicado para el tratamiento de mantenimiento de pacientes con EPOC (incluyendo bronquitis crónica y enfisema). Se indica además para el tratamiento de la disnea asociada a la enfermedad y prevención de exacerbaciones.
Asma
SPIRIVA RESPIMAT está indicado como tratamiento de mantenimiento complementario para la mejoría de los síntomas de asma, la mejoría en la calidad de vida y la reducción de las exacerbaciones en los pacientes de 1 año de edad y mayores con asma, que continúan siendo sintomáticos con la administración de corticoesteroides inhalados.
MECANISMO DE ACCIÓN:
Propiedades farmacológicas
Grupo farmacoterapéutico: Otros fármacos para las enfermedades obstructivas de las vías aéreas, productos inhalables, anticolinérgicos; código ATC: R03B B04. El bromuro de tiotropio es un antagonista de acción prolongada específico de los receptores muscarínicos, a menudo conocido en la práctica clínica con el nombre de anticolinérgico. Tiene una afinidad similar por los subtipos de receptores muscarínicos M1 a M5. En las vías aéreas, la inhibición de los receptores M3 en la musculatura lisa produce relajación. La índole competitiva y reversible del antagonismo quedó demostrada en receptores de origen humano y animal y en preparados aislados de órganos. En estudios no clínicos in vitro e in vivo se observó que los efectos broncoprotectores eran dependientes de la dosis y duraban más de 24 horas. La prolongada duración del efecto probablemente se deba a que la disociación del tiotropio de los receptores M3 es muy lenta, con una semivida de disociación significativamente más prolongada que la observada en el caso del ipratropio. Como anticolinérgico N-cuaternario, el tiotropio es tópicamente (bronco-) selectivo cuando se lo administra mediante inhalación, y presenta un rango terapéutico aceptable antes de dar lugar a efectos anticolinérgicos sistémicos. La disociación de los receptores M2 es más rápida que de los receptores M3, lo cual, en los estudios in vitro funcionales, se tradujo en una selectividad (controlada cinéticamente) por el subtipo de receptores M3 mayor que por aquellos de tipo M2.
La elevada potencia y la lenta disociación de los receptores tuvieron como correlato clínico una broncodilatación significativa y prolongada en los pacientes con EPOC y asma. La broncodilatación que se produce tras la inhalación del tiotropio es primordialmente un efecto localizado (sobre las vías aéreas), y no un efecto sistémico.
CONTRAINDICACIONES:
Spiriva Respimat está contraindicado en pacientes con hipersensibilidad a la atropina o sus derivados, por ej., ipratropio y oxitropio o a cualquiera de los excipientes de este producto.
REACCIONES ADVERSAS:
Efectos sobre la capacidad para conducir vehículos y operar maquinarias
No se han realizado estudios en torno a los efectos de este producto sobre la capacidad para conducir vehículos y operar maquinarias. El desarrollo de mareos y visión borrosa puede afectar la capacidad para conducir vehículos y operar maquinarias.
Efectos secundarios
Muchos de los efectos no deseados mencionados pueden atribuirse a las propiedades anticolinérgicas de SPIRIVA RESPIMAT.
Se identificaron reacciones farmacológicas adversas a partir de datos obtenidos en estudios clínicos y reportados espontáneamente durante el uso comercial del medicamento.
La base de datos de estudios clínicos para EPOC incluye 3.282 pacientes tratados con SPIRIVA RESPIMAT de 7 estudios clínicos controlados comparados con placebo, con períodos de tratamiento que fluctuaron entre cuatro semanas y un año, lo que representa 2.440 personas-años de exposición.
La base de datos de estudios clínicos para asma incluye 1.930 pacientes tratados con tiotropio de 12 estudios comparativos con placebo con períodos de tratamiento de entre doce semanas y un año, lo que representa 1.128 años-persona de exposición al tiotropio.
Trastornos del metabolismo y la nutrición
Deshidratación
Trastornos del Sistema Nervioso
Mareos, insomnio
Trastornos oculares
Glaucoma, aumento de la presión intraocular, visión borrosa.
Trastornos cardíacos
Fibrilación auricular, palpitaciones, taquicardia supraventricular, taquicardia.
Trastornos respiratorios, torácicos y mediastinales Tos, epistaxis, faringitis, disfonía, broncoespasmo, laringitis, sinusitis.
Trastornos gastrointestinales
Boca seca, usualmente leve, constipación, candidiasis orofaríngea, disfagia, enfermedad por reflujo gastroesofágico, gingivitis, glositis, estomatitis, obstrucción intestinal incluyendo íleo paralítico. Trastornos de la piel y el tejido subcutáneo. Trastornos del sistema inmune
Rash, prurito, angioedema, urticaria, infección y úlceras de la piel, piel seca, hipersensibilidad (incluyendo reacciones inmediatas).
Trastornos del tejido osteomuscular y conectivo Inflamación de las articulaciones.
Trastornos renales y urinarios
Retención urinaria (especialmente, en hombres con factores predisponentes), disuria, infección del tracto urinario.
Población pediátrica
La frecuencia, el tipo y la gravedad de las reacciones adversas en los pacientes pediátricos son similares en comparación con los adultos.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacciones
Comuníquele siempre a su médico si se encuentra utilizando o ha finalizado de utilizar recientemente otros medicamentos, inclusive los que no requieran de una receta para ser adquiridos.
Si bien no se han realizado estudios formales de interacciones medicamentosas, el bromuro de tiotropio se ha usado en forma concomitante con otros medicamentos que se prescriben comúnmente para el tratamiento de la EPOC y el asma, incluyendo broncodilatadores simpaticomiméticos, metilxantinas, esteroides orales e inhalables, antihistamínicos, mucolíticos modificadores del leucotrieno, cromonas y tratamiento anti-IgE, sin que se observara evidencia clínica de interacciones medicamentosas.
Se comprobó que los medicamentos que son comúnmente usados en forma concomitante por los pacientes con EPOC (agonistas beta de acción prolongada, corticoesteroides inhalables y sus combinaciones) no alteran la exposición al tiotropio.
La coadministración crónica de bromuro de tiotropio con otros fármacos anticolinérgicos no ha sido estudiada. Por lo tanto, se desaconseja la coadministración crónica de otros anticolinérgicos junto con SPIRIVA RESPIMAT.
INFORMACIÓN COMPLEMENTARIA
Fabricado por: Boehringer Ingelheim Pharma GmbH & Co. KG, Ingelheim am Rhein, Alemania.
Bajo licencia de: Boehringer Ingelheim International GmbH, Ingelheim am Rhein, Alemania.
Ecuador:
Importado y distribuido por: Boehringer Ingelheim del Ecuador Cía. Ltda., Quito, Ecuador. Producto de uso delicado. Adminístrese por prescripción y bajo vigilancia médica.
En Ecuador: Notificación de Reacciones Adversas a Medicamentos: “Es importante notificar las sospechas de reacciones adversas después de la autorización del medicamento. Se invita a los usuarios así como a los profesionales de la salud a notificar las sospechas de reacciones adversas al siguiente e-mail: pv_local_ecuador@boehringer-ingelheim.com; cel. +593 994870886.
Mediante la notificación Ud. puede contribuir a proporcionar mayor información sobre la seguridad del medicamento.”
Versión 10.
Mayor información disponible a
solicitud del cuerpo médico.
Boehringer-Ingelheim
del Ecuador Cía. Ltda.
Quito
Av. Shyris N-344 y Av. Eloy Alfaro.
Edificio Parque Central, Piso 15
Teléfono: 593 2 397990
RECOMENDACIONES:
Advertencias y precauciones especiales
Siempre debe comunicarle a su médico si:
• Está tomando algún otro producto medicinal que contenga ipratropio y oxitropio.
• Si está embarazado, piensa usted que está embarazada o está en período de lactancia (amamantando).
• Presenta visión borrosa, dolor ocular y/u ojos rojos, problemas de próstata o tiene dificultad para orinar.
• Tiene algún problema en los riñones.
Cuando use Spiriva Respimat tenga cuidado en no permitir que el spray entre en sus ojos. Esto puede resultar en dolor o molesta ocular, visión borrosa, visión de halos alrededor de las luces o imágenes coloreadas asociadas con ojos rojos (es decir, glaucoma de ángulo estrecho). Los síntomas oculares pueden acompañarse de dolor de cabeza, náuseas y/o vómitos. Lave sus ojos con agua tibia, deje de usar el bromuro de tiotropio y consulte inmediatamente a su médico para que le aconseje qué conducta tomar.Si su respiración ha empeorado o si usted presenta rash (erupción cutánea), hinchazón o picazón directamente después de usar su inhalador, deje de usarlo y comuníqueselo a su médico inmediatamente.
La boca seca, puede asociarse a largo plazo con caries dentales. Por lo tanto, recuerde prestar atención a su higiene oral.
SPIRIVA RESPIMAT está indicado para el tratamiento de mantenimiento de su enfermedad pulmonar obstructiva crónica. No debe usarse para tratar un ataque repentino de falta de aire.
SPIRIVA RESPIMAT está indicado para el tratamiento de mantenimiento del asma, no debe usarse como tratamiento de primera elección para el asma. Se debe advertir a los pacientes asmáticos que deben continuar tomando su tratamiento habitual (antiinflamatorio, corticoide, entre otros), aunque los síntomas mejoren.
No use SPIRIVA RESPIMAT con una frecuencia mayor a una vez al día. Debe contactar a su médico si siente que su respiración está empeorando.
Los medicamentos inhalables pueden causar broncoespasmo inducido por la inhalación. Los cartuchos de Spiriva se deben usar únicamente con el inhalador Respimat.
Fertilidad, embarazo y lactancia
Embarazo
Existe una cantidad limitada de datos sobre el uso del tiotropio en las mujeres embarazadas. Los estudios preclínicos no indican efectos nocivos directos ni indirectos en lo que se refiere a la toxicidad para la reproducción en las dosis clínicamente relevantes (véase la sección “Toxicología”).
Como medida de precaución, es preferible evitar el uso de SPIRIVA RESPIMAT durante el embarazo.
Lactancia
No hay disponibles datos clínicos sobre mujeres que hayan sido expuestas al tiotropio durante el período de lactancia. Los estudios en roedores en período de lactancia han indicado que una pequeña cantidad de tiotropio se excreta en la leche materna.
Por lo tanto, SPIRIVA RESPIMAT no debe ser usado en mujeres embarazadas o en período de lactancia, a menos que el beneficio previsto supere todo posible riesgo para el bebé en gestación o el lactante.
Fertilidad
No existen datos clínicos en relación con el efecto del tiotropio sobre la fertilidad. Un estudio preclínico realizado con tiotropio no reveló indicio alguno de efectos adversos sobre la fertilidad (véase la sección “Toxicología”).
DOSIS Y VÍA DE ADMINISTRACIÓN:
Posología y administración
El médico debe indicar la posología y el tiempo de tratamiento apropiado a su caso particular, no obstante la dosis recomendada de SPIRIVA RESPIMAT es la inhalación de la solución pulverizada que se obtiene a partir de dos aplicaciones (puffs) una vez al día mediante el inhalador RESPIMAT a la misma hora todos los días (ver “Instrucciones de uso”).
En el tratamiento del asma, los beneficios completos se observan luego de varias dosis de SPIRIVA RESPIMAT.
Poblaciones especiales
Los pacientes de edad avanzada pueden usar SPIRIVA RESPIMAT en la dosis recomendada.
Los pacientes con insuficiencia renal pueden usar SPIRIVA RESPIMAT en la dosis recomendada. No obstante, como sucede con todos los fármacos cuya excreción es predominantemente renal, se deberá efectuar un estrecho control del uso de SPIRIVA RESPIMAT en los pacientes con insuficiencia renal moderada a severa.
Los pacientes con insuficiencia hepática pueden usar SPIRIVA RESPIMAT en la dosis recomendada.
Población pediátrica
La EPOC normalmente no se produce en los niños. En asma, la posología recomendada de SPIRIVA RESPIMAT en pacientes entre 1 y 17 años de edad es la inhalación de la solución pulverizada que se obtiene a partir de dos aplicaciones (puffs) una vez al día mediante el inhalador RESPIMAT, a la misma hora todos los días (ver Instrucciones de uso). En niños entre 1 y 5 años de edad, Spiriva Respimat se debe utilizar con un espaciador adecuado (por ejemplo, AeroChamber® Plus Flow-Vu®) con una mascarilla.
La eficacia y la seguridad de SPIRIVA RESPIMAT en pacientes pediátricos menores de 1 año de edad con asma no han sido determinadas.
SPIRIVA RESPIMAT descartable
Introducción
SPIRIVA RESPIMAT (bromuro de tiotropio). Lea estas Instrucciones de uso, antes de comenzar a usar SPIRIVA RESPIMAT.
Los niños deben utilizar SPIRIVA RESPIMAT con la ayuda de un adulto. En pacientes entre 1 y 5 años de edad, se debe utilizar SPIRIVA RESPIMAT con un espaciador adecuado con una mascarilla.
Debe utilizar este inhalador solamente UNA VEZ AL DÍA. Cada vez que lo use, inhale dos aplicaciones (puffs).

Cómo cuidar su inhalador SPIRIVA RESPIMAT
Al menos una vez a la semana, debe limpiar la boquilla, incluyendo la parte metálica del interior de la boquilla, únicamente con un paño o pañuelo de papel húmedo.
Puede producirse un ligero cambio en el color de la boquilla, que no afecta el funcionamiento de su inhalador SPIRIVA RESPIMAT descartable.
Cuándo adquirir un nuevo inhalador SPIRIVA RESPIMAT

• El inhalador SPIRIVA® RESPIMAT® contiene 60 aplicaciones (30 dosis) si se lo usa según se indica (dos aplicaciones/una vez al día).
• El indicador de dosis muestra de manera aproximada cuánta medicación queda.
• Cuando el indicador ingrese en la zona roja de la escala, usted deberá conseguir una nueva receta; quedará medicación para aproximadamente, 7 días más (14 aplicaciones).
• Una vez que el indicador de dosis llegue al final de la escala roja su SPIRIVA® RESPIMAT® se trabará automáticamente y no liberará más dosis. A partir de ese momento, ya no se podrá girar más la base.
• Una vez cumplidos tres meses desde el primer uso, el inhalador SPIRIVA® RESPIMAT®, deberá ser desechado aunque no haya sido utilizado.
Preparar el inhalador para usarlo por primera vez 1. Retire la base transparente
• Mantenga la tapa cerrada.
• Presione el cierre de seguridad mientras retira la base transparente con la otra mano.

2. Inserte el cartucho
• Introduzca en el inhalador el extremo del cartucho de menor diámetro.
• Coloque el cartucho sobre una superficie dura y presione con firmeza hasta que quede correctamente ubicado.
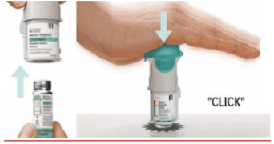
3. Coloque nuevamente la base transparente
• Coloque la base transparente en su lugar hasta que haga click.

4. Gire
• Mantenga la tapa cerrada.
• Gire la base transparente en el sentido de las flechas de la etiqueta hasta que haga click (media vuelta).

5. Abra
• Abra la tapa por completo.

6. Presione
• Apunte el inhalador hacia el suelo.
• Presione el botón de liberación de dosis.
• Cierre la tapa.
• Repita los pasos 4 a 6 hasta que se forme una nube visible.
• Cuando se haya formado una nube visible, repita los pasos 4 a 6 tres veces más.

Uso diario
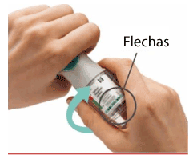
Gire
• Mantenga la tapa cerrada.
• GIRE la base transparente en el sentido de las flechas de la etiqueta hasta que haga click (media vuelta).
Abra
• Abra la tapa por completo.

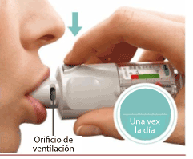
Presione
• Exhale en forma lenta todo el aire de los pulmones.
• Coloque sus labios alrededor de la boquilla sin cubrir los orificios de ventilación.
• Mientras inhala lenta y profundamente por la boca, PRESIONE el botón de liberación de dosis y continúe inhalando.
• Contenga la respiración durante10 segundos o durante todo el tiempo que pueda sin que llegue a resultarle incómodo.
• Repita los pasos "Gire", "Abra", "Presione" para recibir dos aplicaciones.
Preguntas frecuentes
Me cuesta insertar el cartucho hasta el fondo ¿Giró accidentalmente la base transparente antes de insertar el cartucho? Abra la tapa, presione el botón dosificador, luego, inserte el cartucho.
¿Insertó el cartucho por el lado más ancho? Inserte el cartucho por el lado más angosto.
No puedo presionar el botón dosificador
¿Giró la base transparente? Si no la giró, gírela de un solo movimiento hasta que haga clic (media vuelta).
¿El indicador de dosis de SPIRIVA RESPIMAT está señalando el cero? El inhalador SPIRIVA RESPIMAT queda bloqueado tras 60 inhalaciones (30 dosis medicinales). Prepare y use un inhalador SPIRIVA RESPIMAT nuevo.
No logro girar la base transparente
¿Ya giró la base transparente?
Si ya había girado la base transparente, siga los pasos “ABRA” y “PRESIONE” de la sección “Uso diario”. Eso bastará para que salga el medicamento.
¿El indicador de dosis de SPIRIVA RESPIMAT está señalando el cero?
El inhalador SPIRIVA RESPIMAT queda bloqueado tras 60 inhalaciones (30 dosis medicinales). Prepare y use un inhalador SPIRIVA RESPIMAT nuevo.
El indicador de dosis de SPIRIVA RESPIMAT llega a cero antes de lo esperable
¿Usó SPIRIVA RESPIMAT como se indica (dos inhalaciones / una vez al día)? Aplicando dos inhalaciones una vez al día, SPIRIVA RESPIMAT dura 30 días.
¿Giró la base transparente antes de insertar el cartucho? El indicador de dosis cuenta todas las veces que se gira la base transparente, haya o no un cartucho inserto. ¿Hizo varias atomizaciones al aire para ver si estaba funcionando el SPIRIVA RESPIMAT?
Una vez que preparó el SPIRIVA RESPIMAT, mientras lo use todos los días, no necesita hacer ninguna atomización de prueba.
¿Insertó el cartucho en un SPIRIVA RESPIMAT usado? Siempre inserte un cartucho nuevo en un SPIRIVA RESPIMAT NUEVO. Mi SPIRIVA RESPIMAT se dispara solo
Tenía la tapa abierta cuando giró la base transparente? Cierre la tapa y luego gire la base transparente.
¿Presionó el botón dosificador al girar la base transparente? Cierre la tapa bien, para que quede cubierto el botón dosificador y luego gire la base transparente.
¿Dejó de girar la base transparente antes de que hiciera clic? Gire la base transparente de un solo movimiento hasta que haga clic (media vuelta).
No sale nada de mi SPIRIVA RESPIMAT
¿Insertó un cartucho? Si no insertó un cartucho, insértelo.
¿Repitió los pasos “Gire”, “Abra” y “Presione” menos de tres veces después de insertar el cartucho?
Repita los pasos “Gire”, “Abra” y “Presione” tres veces tras insertar el cartucho, tal como se muestra en los pasos 4 a 6 de la sección “Preparar el inhalador para usarlo por primera vez”.
¿El indicador de dosis de SPIRIVA RESPIMAT está señalando el 0?
Si el indicador de dosis señala el 0, ya se le gastó el medicamento, y el inhalador queda bloqueado.
Una vez armado el SPIRIVA RESPIMAT, no quite la base transparente ni el cartucho. Siempre inserte un cartucho nuevo en un SPIRIVA RESPIMAT NUEVO.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Sobredosis
Las dosis altas de SPIRIVA RESPIMAT pueden provocar signos y síntomas anticolinérgicos.
No se observaron efectos adversos relevantes, excepto sequedad de la boca/garganta y sequedad de la mucosa nasal, cuya incidencia fue dependiente de la dosis [10-40 μg diarios], luego de la administración durante 14 días de dosis de hasta 40 μg de solución inhalable de tiotropio en voluntarios sanos, a excepción de una notable reducción de la salivación del día 7 en adelante. No se ha observado ningún efecto indeseado significativo en seis estudios a largo plazo realizados en pacientes con EPOC tratados con una dosis diaria de 10 μg de solución inhalable de tiotropio durante 4 a 48 semanas.
PRESENTACIÓN:
En Ecuador: Reg. Sanitario N° 1559-MEE-1215.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Condiciones de almacenamiento
No congelar. Consérvese a una temperatura no mayor a 30ºC.
LEYENDAS DE PROTECCIÓN:
Manténgase fuera del alcance de los niños.
Venta bajo receta médica.